Омега-3 в качестве иммуномодуляторов в колоректальном раке
Научная статья итальянских ученых о влиянии омега-3 на возможность профилактики и лечения рака кишечника и рака прямой кишки. (колоректального рака)
Влияние диеты c омега-3 на развитие и прогрессирование рака. Общие положения
Состав диеты может влиять на начало и прогрессирование хронических дегенеративных заболеваний, включая рак, патогенез которого зависит от воспалительных процессов. Растущие данные свидетельствуют о том, что диета и ее компоненты критически влияют на здоровье человека, влияют на иммунную систему, секрецию адипокинов и метаболические пути.
Колоректальный рак (КРР) – медицинское определение злокачественной опухоли слизистой оболочки толстой кишки (колон) или прямой кишки (ректум). КРР является одной из ведущих причин смерти во всем мире. Противоопухолевые препараты широко используются для лечения КРР, но лекарственная устойчивость и или нецелевая токсичность ограничивают их эффективность.
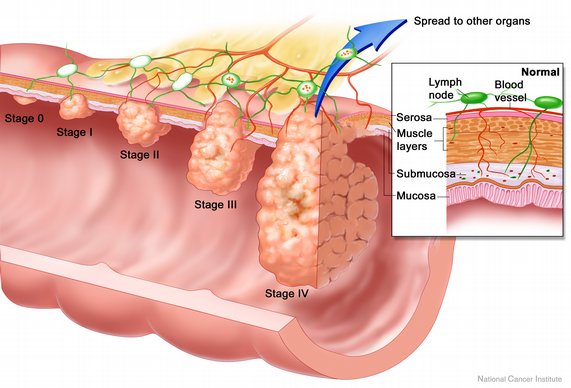
Диетические полиненасыщенные жирные кислоты (ПНЖК) в последние годы проявляют большой интерес к противовоспалительным и противораковым агентам, особенно в таких областях, как большой кишечник, где провоспалительный контекст способствует практически всем стадиям канцерогенеза толстой кишки.
Растущие эпидемиологические, экспериментальные, и клинические данные свидетельствуют о том, что омега 3 ПНЖК может играть определенную роль на нескольких стадиях управления КРР, проявляя противоопухолевую активность против клеток КРР человека, повышая эффективность радиации и химиотерапии, улучшая связанные с раком вторичные осложнения и предотвращая рецидив рака кишечника.
Эти эффекты, скорее всего, связаны с иммуномодулирующей активностью ω3 , которые способны влиять на несколько аспектов воспалительного процесса, начиная от активации воспаления, лейкоцитарного рекрутинга, продуцирования иммунных медиаторов до дифференцировки и активации иммунных клеток.
В этом обзоре мы сосредоточимся на потенциальном использовании омега 3 кислот в качестве адъювантных агентов вместе с химиотерапией / лучевой терапией, выделив иммуномодулирующие эффекты, наиболее вероятно ответственные за их положительные эффекты на разных этапах управления CRC.
ВВедение. Воспаление и риск развития рака кишечника (КРР)
Становится все более очевидным, что диетические привычки могут влиять на риск / прогрессирование хронических заболеваний с патогенным воспалительным компонентом, таким как колоректальный рак (КРР или CRC) . КРР является третьим наиболее распространенным раком и четвертой ведущей причиной смерти от рака во всем мире и представляет собой клиническую модель рака, показывающую тесную связь с воспалением и факторами окружающей среды.
Воспаление в настоящее время считается признаком рака , и, как сообщается, обострившиеся воспалительные процессы способствуют воспалению нескольких типов опухолевых заболеваний, их прогрессированию, а также худшему прогнозу для пациента с раком (World Cancer Report, 2014, IARC).
Несколько типов воспаления, различающихся по причине, механизму, результату и интенсивности, могут способствовать развитию рака и прогрессированию. Интересно, что рост тенденций снижения CRC в основном рассматривается как часть изменения образа жизни, включая калорийно чрезмерную диету с высоким содержанием жиров / низким содержанием клетчатки, отсутствие физической активности и ожирение.
Эпидемиологические и клинические исследования последовательно свидетельствуют о значительной взаимосвязи между воспалением, вызванным ожирением, и большинством этапов развития CRC, включая инициирование, продвижение, прогрессирование и метастазы . Кроме того, терапия рака, а также хирургия для резекции рака могут спровоцировать воспалительный ответ, вызвав травму, некроз и повреждение тканей, которые стимулируют повторное появление опухоли и резистентность к терапии .
Несмотря на прогресс, достигнутый в последние годы в лечении рака, клиническая значимость обычных терапевтических модальностей только в твердых опухолях, включая CRC, по-прежнему вызывает серьезные проблемы из-за высоких затрат на лекарства и неудовлетворительных долгосрочных клинических результатов.
Таким образом, из-за воздействия воспаления как фактора риска развития CRC, а также в ходе заболевания появляются новые концепции преимуществ, которые могут быть получены из комбинации традиционных процедур CRC с стратегиями вмешательства, нацеленными на ингибирование / ослабление хроническое воспаление.
Примечательно, что диетические компоненты влияют на воспалительные процессы, в том числе воспаление кишечника, и полагают, что диетические привычки играют важную роль в риске CRC . Поэтому значительное внимание было направлено на способность питательных агентов ориентироваться на основные молекулярные пути, связанные с воспалением, связанным с раком. Недавно было принято, что жирные кислоты (ФА) являются основными детерминантами воспаления и могут влиять на риск связанных патологий. Учитывая, что их предшественник сигнализирует липидные медиаторы, FA действуют как лиганды для ключевых иммунных рецепторов, и их активация может инициировать и увековечить врожденный иммунный ответ.
Диетические полиненасыщенные жирные кислоты омега-3
Омега 3 и Омега 6 являются полиненасыщенные жирные кислоты (PUFA, ПНЖК), определение которых происходит от подсчета атомов углерода после последней двойной связи в конце цепи жирных кислот . Тип реакции, которую они вызывают, сильно зависит от их биохимических свойств, главным образом связанных с числом и положением двойных связей . В связи с этим, ω3 и ω6 проявляют различное поведение в отношении воспалительного процесса, проявляя противовоспалительную или провоспалительную активность соответственно.
Благодаря предлагаемой конкурентной роли PU3 и ω6 ПНЖК их диетический состав, как было предложено, является биологически правдоподобной целью для управления рака кишечника (КРР). Кислоты омега 3 и омега 6 представляют собой природные вещества, необходимые для биологического процесса с ключевыми ролями в структуре и функции фосфолипидной мембраны, клеточной передаче сигналов и липидном обмене.
Источники омега-3 и влияние диеты на риски рака
В организме человека α3-линоленовая кислота (ALA, 18: 3ω3), а также предшественники ряда ПРЖК-линолевой кислоты (LA, 18: 2ω6) являются существенными FA, которые не могут быть синтезированы людьми и поэтому должны быть приняты из диетических источников, включая рыбу, семена льна, грецкие орехи и водоросли . Несколько видов пищи, богатой ω3 PUFA, типичны для так называемой средиземноморской диеты (MD).
Несколько эпидемиологических исследований оценили влияние этой диеты как защиту от ряда заболеваний, связанных с хроническим низкосортным воспалением, таким как рак, диабет, ожирение, атеросклероз, метаболический синдром и расстройства познания.
Было установлено, что приверженность традиционному МД ассоциируется с значительно и значительно сниженной частотой сердечно-сосудистых заболеваний и общего рака . Из-за плохой эндогенной конверсии ALA в ее более длинные и более высоконасыщенные FA, существуют значительные споры относительно того, могут ли более длинные версии, такие как эйкозапентаеновая кислота (EPA, 20: 5ω3) и докозагексаеновая кислота (DHA, 22: 6ω3) (. Эти ПНЖК являются ключевыми компонентами клеточной мембраны, липопротеинов и жировой ткани (АТ), состав которых тесно отражает потребление пищи .
Влияние диеты с Омега-3 на риски рака
В течение нескольких лет влияние омега 3 широко изучалось для профилактики сердечно-сосудистых заболеваний . Совсем недавно их способность оказывать противоопухолевую активность была признана.
Множество исследований указывало на СО3 ПНЖК и их окислительные метаболиты в качестве потенциальных противовоспалительных и противораковых агентов, особенно в таких областях, как крупный кишечник, где влияние перорально вводимых веществ велико, а опухоли демонстрируют нарушения структуры ПНЖК. В частности, модифицированные профили PUFA и ω6 PUFA были обнаружены в сыворотке и раковой ткани пациентов с CRC, что предполагает возможное изменение метаболизма PUFA, которое может играть роль в канцерогенезе колоректального канцерогенеза .
В целом, эти исследования показали, что метаболизм ПНЖК играет роль в канцерогенезе колоректального рака, вызванном воспалением, и, вероятно, зависит от размера опухоли. В связи с этим важно, чтобы отношение омега3 /6 к промышленно развитым диетам было несбалансированным, и это условие приводит к хорошо известному провоспалительному эффекту . Примечательно, что снижение отношения ω3 / ω6 ПНЖК висцерального АТ коррелирует с AT-воспалительным статусом у пациентов с КРК, предполагая, что качественные, более чем количественные изменения ПНЖК в АТ могут влиять на дисфункции тканей, потенциально связанные с воспалительными состояниями.
Аналогично, количество некоторых ПНЖК [то есть гамма-линоленовой кислоты (GLA), дигомомамма-линоленовой кислоты (DGLA) и арахидоновой кислоты (АА)] как в висцеральном, так и подкожном AT было статистически выше у пациентов с раком по сравнению со здоровыми людьми . В целом, эти наблюдения подтверждают концепцию, что нарушение ПНЖК происходит не только в опухолевой ткани, но также в микроокружении и системных уровнях, что, скорее всего, способствует воспалению, связанному с опухолью.
В настоящее время имеется достаточное количество данных из проспективных исследований, свидетельствующих о том, что потребление рыбы или рыбьего жира ω3 в ПНЖК обратно пропорционально связано с распространенностью рака прямой кишки среди населения в целом.
Однако результаты, полученные в ходе недавнего метаанализа, проведенного для оценки влияния ω3 PUFA на воспалительные маркеры у пациентов с колоректальный раком, показали, что положительные эффекты омега 3 основаны на протоколах дополнения (например, дозе, продолжительности и пути введения) , принятый сопутствующему противораковому режиму, а также о смешающих эффектах других питательных веществ, которые могут присутствовать в добавке.
В этой связи следует учитывать, что наблюдательные исследования, проведенные для оценки потенциальных противораковых эффектов омега 3, могли быть ограничены недостаточной однородностью наблюдений. Объяснение такой гетерогенности, вероятно, зависит от присущих им проблем, связанных с эпидемиологией, включая контекст смешения и диеты, погрешность измерения, уровень потребления и генетические полиморфизмы .
Несмотря на то, что большинство исследований доказали, что введение ω3 PUFA не является токсичным или канцерогенным, трудно представить, что эти соединения могут быть использованы только в лечении рака. Тем не менее, растущие эпидемиологические, экспериментальные и клинические данные, свидетельствующие о положительном эффекте ω3 ПНЖК на нескольких этапах лечения CRC, представляют собой обоснованное обоснование их использования в терапевтических комбинационных стратегиях .
Антинеопластические эффекты омега 3 были изучены на протяжении многих лет, и было предложено несколько биологических механизмов, чтобы объяснить их ингибирующее действие на рост раковых клеток . Однако в последние годы все большее внимание уделяется противоопухолевой активности омега 3, связанной с действием этих биоактивных молекул на воспалительный процесс, из-за патогенной роли воспаления в развитии многих видов опухолей. ω3 , особенно EPA и DHA, появились как питательные вещества, способные модулировать как метаболические, так и иммунные процессы.
Как показано в таблице1 , эти ПНЖК способны модулировать ряд аспектов воспалительного процесса , начиная от инфламмасомы активации, набора лейкоцитов, а также производства иммунных медиаторов, к дифференциации и активации клеток иммунной системы . эффекты ω3 PUFA опосредуются различными механизмами, включая как внеклеточные (например, GPR120) и внутриклеточные (например, PPARγ) рецепторы, которые контролируют сигнальную передачу воспалительных клеток и экспрессию генов.
Несмотря на многочисленные усилия, остается полностью определить, как эти соединения могут влиять на такое разнообразие молекулярных путей и функций клеток / тканей с помощью плейотропных положительных эффектов и как эти механизмы взаимосвязаны. Некоторые из Омега 3 опосредованных событий, по-видимому, полагаются, по крайней мере частично, на изменения в составе FA мембранных фосфолипидов, релевантные для получения медиаторов липидов, и формирование липидных плотов в ответ на воспалительные стимулы .
Таблица 1.
Иммуномодулирующие эффекты ω3 PUFA в моноцитах / макрофагах и Т-лимфоцитах
.
| ω3 воздействие ПНЖК | Экспериментальная / животная модель | Наблюдаемый эффект | Предлагаемый механизм | Справка |
|---|---|---|---|---|
| DHA a , EPA a | MU и HU моноцитарные клеточные линии; MU и HU первичный моноцит / Mφ, мышей C57BL / 6 | ↓ воспалительная активация | GPR120-β арест-2-опосредованное ингибирование NF-kB | ( |
| Улучшенная аутофагия | ||||
| Нарушение димеризации TLR2 / TLR1 | ||||
| Isocaloric HFD-содержащий 27% рыбьего жира menhaden (16% EPA, 9% DHA); изокалорический СО3 обогащенный PUFA рацион (3% мендаден рыбьего жира + 7% сафлорового масла) | Мышей C57BL / 6 | ↓ хемотаксис лейкоцитов | GPR120, β-арест-2 | |
| Подавление NF-kB и STAT3 | ||||
| DHA a , EPA a | Моноцитарные линии MU и первичные Mφ | ↑ эффероцитарная активность Mφ | PPARγ и активация AKT | ( |
| DHA a , EPA a , изокалорическое HFD-содержащее 27% рыбьего жира menhaden (16% EPA, 9% DHA); HFD + DHA a | Моноцитарные линии MU и первичные Mφ | ↑ M2 Mφ поляризация | GPR120, β-арест-2 | |
| Мышей C57BL / 6 | ||||
| DHA a , EPA a , ω3 обогащенная PUFA диета b , обогащенная DHA диета (омегавие DHA90 TG) | BALB / c и C57BL / 6 мышей MU селезенки и костного мозга DC | ↓ активация Т-клеток ↑ Поляризация Th2-лимфоцитов ↓ ПоляризацияTh17-лимфоцитов ↑ экспрессия и генерация T reg |
Взаимодействие с сигнальным путём STAT3 посредствомусиления PPAR-индуцированного SOCS3 | |
| ↓ T regсупрессивная и миграционная функция ↓ Активация постоянного тока ↓ активация T-клеток, опосредованная DC ↑ DC-опосредованноерасширение T reg |
M2 Mφ опосредованный |
В таблице показано резюме основных публикаций о иммуномодулирующем эффекте ω3 PUFA в моноцитах / макрофагах и Т-лимфоцитах, включая как исследования in vitro, так и модели животных in vivo .
MU, мыши; HU, человек; Mφ, макрофаг; DC, дендритная клетка; HFD, диета с высоким содержанием жиров; GPR120, G-белковый рецептор 120 .
Химически синтезируют .
b ω3 Источник PUFA: масло семян Perilla, масло рыбьего жира и масло EPAX (EPAX-7010), содержащее ~ 85% ω3 PUFA (70% EPA, 12% DHA) .
Защитные противовоспалительные эффекты полиненасыщенных жирные кислот омега-3 в колоректальном раке
Значительные дебаты по-прежнему существуют в отношении механизмов, лежащих в основе защитных эффектов, оказываемых омега 3 на возникновение / прогрессирование воспаления и рака . Кроме того, необходимо определить точный механизм, который действует в конкретном районе тела, таком как кишечник.
Было предложено несколько механизмов для объяснения способности омега 3 вмешиваться в важные этапы канцерогенеза колоректального рака , включая изменения клеточного окислительно-восстановительного состояния и модуляции динамики мембраны, а также функцию поверхностных рецепторов, которые регулируют клеточную пролиферацию и апоптоз. Из-за тесной связи CRC с воспалением способность ω3 PUFA модулировать некоторые аспекты воспаления и иммунного ответа становится все более важной. В связи с этим представляется интересным, что ω3 PUFA ингибирует активацию рецепторов распознавания образов, индуцирующих агонист, таким образом, увлажняет воспаление . Однако только в немногих исследованиях основное внимание уделялось роли опосредованных PUFA иммуномодулирующих эффектов в терапии CRC.
Из-за обилия двойных связей EPA и DHA восприимчивы к окислению и могут подвергаться спонтанному неферментативному перекислению или ферментативному окислению, приводящему к появлению множества биологически активных липидов, которые индуцируют воспаление, опухолегенез и тромбоз. Одним из основных механизмов, с помощью которых ω3 PUFA оказывают свою противовоспалительную активность, являются ферментативные пути, которые гиперактивированы в КРР, такие как циклооксигеназа (COX) и липоксигеназа (LOX), и приводят к простагландину E 2 (PGE 2 ), мощный провоспалительный и прокарциногенный агент. Было показано, что EPA и DHA ингибируют экспрессию COX-2 в клетках CRC, и этот эффект был обусловлен способностью омега 3 вытеснять омега 6 в частности AA, из мембран. Эта метаболическая конкуренция обусловлена структурным сходством EPA и AA, которые конкурируют друг с другом за те же ферменты, COX и LOX, что является очень важным событием в развитии опухоли. Кроме того, добавка с омега 3 значительно снижает эйкозаноиды, полученные из АА, при увеличении эйкозаноидов, полученных из EPA, смещение баланса в сторону пониженного уровня воспаления .
Интересно, что аспирин, нестероидный противовоспалительный препарат, обладает как ингибирующим действием COX, так и LOX, и усиливает продукцию противовоспалительного липидного медиатора липоксина A4. Аналогично, противовоспалительные соединения образуются из EPA и DHA под действием аспирина, называемого резольвинами (из EPA и DHA), а также защитами и марезинами из DHA . Следует отметить, что регулярное использование аспирина существенно снижает риск колоректального рака.
Провоспалительные цитокины и миелоидные и иммунные клетки, поражающие опухоль, играют критические роли практически на всех стадиях развития связанных с воспалением раковых заболеваний, от начала, продвижения и прогрессирования до злокачественных метастазов.
Недавно опубликованный метаанализ эффектов омега 3 ПНЖК на воспалительных маркерах выявил снижение уровня некоторых воспалительных медиаторов (цитокинов или белков острой фазы) у пациентов с CRC, которые получали добавку омега 3 . Аналогичным образом, недавнее исследование in vitro описывает новые противовоспалительные и противораковые свойства DHA. Fluckiger и коллеги сообщили, что ингибирование роста рака толстой кишки и активация апоптоза DHA включают аутокринную продукцию TNFα через микроРНК (miR) -21 .
Другой механизм, связанный с противовоспалительным и потенциально противоопухолевым эффектом ω3 PUFA, касается возможности того, что эти соединения могут модулировать эпигенетически (посредством метилирования ДНК, модификаций ацетилирования и регуляции гена miR) экспрессию критических генов, участвующих в клеточных процессах, связанных с колоректальным канцерогенезом . Совсем недавно эпигенетическая регуляция экспрессии генов и поляризация макрофагов в направлении разрешающего фенотипа M2 появились как новые механизмы, объясняющие противоопухолевые эффекты ω3 PUFA на уровне толстой кишки, хотя необходимы дополнительные исследования для более глубокого понимания этой проблемы. Наконец, способность омега 3 модулировать воспалительные пути и генерировать липидные медиаторы, критические для разрешения воспаления (например, резольвины, защитные и марезины), привлекла внимание в качестве основного механизма, связанного с положительным эффектом омега 3 против рака кишечника.
Омега-3 ПНЖК в качестве потенциальных адъювантов в терапии колоректального рака
Жирные кислоты могут влиять на канцерогенез с помощью различных механизмов. EPA и DHA включены в клеточные мембраны и посредством получения медиаторов липидов и могут оказывать противораковые свойства, влияя на экспрессию гена или активируя молекулы трансдукции сигнала, участвующие в контроле пролиферации, дифференцировки, апоптоза и метастазирования клеток. Эти свойства ω3 PUFA предполагают, что они будут иметь важный терапевтический потенциал при лечении рака.
У пациентов, перенесших операцию, риск развития осложнений в послеоперационном периоде частично вызван изменениями иммунного ответа после операции . Таким образом, изначально гипер-воспалительный ответ, сопровождаемый фазой относительной иммунной некомпетентности, возникает в связи с сложной хирургией. Пациенты, которые проходят хирургическое вмешательство для CRC, имеют 30% -ный риск инфекционных осложнений, а анастомотические утечки наблюдаются у 15% пациентов .
Первоначальные исследования показали, что введение обогащенных PUFA диет приводит к увеличению включения EPA и DHA не только в ткани слизистой оболочки печени и кишечника, но также и в опухолевой ткани у пациентов с солидными опухолями верхнего желудочно-кишечного тракта . Это наблюдение показало, что предоперационное введение устных обогащенных ПНЖК диет может оказать влияние на послеоперационный воспалительный ответ после крупной абдоминальной хирургии.
Впоследствии в проспективном рандомизированном двойном слепом одноцентровом плацебо-контролируемом исследовании было продемонстрировано более высокое общее содержание морской соли СО3 в слизистой оболочке толстой кишки, но не в мышечном слое, после 7 дней перорального EPA + DHA добавление к пациентам, допущенным к плановой хирургии CRC. Кроме того, при одновременном предоставлении ω3 PUFA в течение 7 дней до операции приводило к значительному уменьшению образования провоспалительного лейкотриена B4 (LTB4) у нейтрофилов с одновременным увеличением производства LTB5. Однако клинические последствия этих изменений до сих пор неизвестны, поскольку корреляции между значениями LTB4 или LTB4 / LTB5 не установлены, и были обнаружены послеоперационные осложнения.
Аналогичным образом, более высокая степень включения EPA, DHA и докозапентаеновой кислоты в гранулоциты обогащенной СО3 добавленной PUFA группы пациентов с CRC не была связана с улучшенными послеоперационными результатами. Таким образом, эффекты ω3 ПНЖК на предоперационные осложнения необходимо исследовать в более крупных исследованиях и в течение более длительного периода (месяцев) приема ω3 PUFA, чтобы четко определить, является ли образование LTB активированными нейтрофилами / не важным фактором, определяющим хирургические осложнения.
В нескольких исследованиях было показано положительное влияние ω3 PUFA как химиопревентивных и химиотерапевтических агентов на лечение нескольких хронических патологий, включая рак, свидетельствующий о потенциальном использовании этих соединений для повышения эффективности химиотерапии / лучевой терапии и снижения риска рецидива опухоли. Кроме того, в нескольких исследованиях показано, что EPA и DHA, обладающие иммуномодулирующей способностью, уменьшают воспаление, даже когда они связаны с подавлением иммунной системы / лучевой терапии в легких и другими видами рака .
В частности, Сюэ и его коллеги оценили, может ли добавление СО3 ПНЖК влиять на эффективность циклической комбинированной обработки с помощью Иринотекана (СРТ-11) / 5-фторурацила (5-ФУ) в модели КРС крысы. Введение диеты, обогащенной ω3 PUFA, до начала химиотерапии, ингибировало рост опухоли, тогда как во время химиотерапии, ω3 обогащенная ПНЖК диета улучшала хемочувствительность опухоли и уменьшала потерю массы тела в отношении контрольных крыс, кормящих раком.
В других исследованиях рассматривался вопрос о том, может ли добавление с помощью омега3 ПНЖК к пациентам с CRC, проходящим химиотерапию, индуцировать изменения маркеров воспаления, такие как отношение C реактивного белка (CRP) к альбумину, считается соответствующим клиническим / воспалительным маркером. В этом отношении некоторые клинические испытания продемонстрировали, что добавка EPA и DHA во время химиотерапевтических обработок улучшала значения CRP, статус CRP / альбумина и положительно модулировала питательный статус пациентов с CRC. Аналогичным образом, оценка клинических исходов во время и после химиотерапии у пациентов с CRC, дополненная рыбьего жира, содержащего EPA и DHA, в течение первых 9 недель лечения была распущена, что время до прогрессирования опухоли было значительно больше в дополнение к контрольной группе .
Интересно, что недавнее рандомизированное рандомизированное плацебо-контролируемое исследование по назначению EPA для пациентов с CRC, перенесших операцию по резекции печени, показало, что EPA включено в вторичную ткань CRC и имеет системную противовоспалительную активность. В частности, четкое снижение метаболита мочи PGE-M, отражающее системный PGE 2уровни, а также обратимое снижение связывания NF-kB в лейкоцитах периферической крови наблюдалось у пациентов, получавших EPA, в отношении группы плацебо ( 80 ). В целом, эти наблюдения, которые могут представлять собой инновационную комбинационную терапию, способствуют замедлению прогрессирования опухоли и, вероятно, усиливают противоопухолевую активность химиотерапевтических препаратов. Дизайн и основные признаки клинических испытаний , проведенных на CRC пациентов с добавлением П3 ПНЖК, описанных выше, приведены в таблице 2
Таблица 2. Клинические эффекты ω3 PUFA у пациентов с CRC .
| ω3 ежедневное лечение ПНЖК | Хирургия | nПредметы | Сроки / продолжительность | химиотерапия | Наблюдаемый эффект | Критерии оценки | Справка |
|---|---|---|---|---|---|---|---|
| 1 г DHA + 2 г EPA перорально | да | 148 | 7 дней до операции | нет | Потенциальное положительное влияние на местную иммунную функцию | ω3 Содержание ПНЖК в слизистой оболочке толстой кишки и мышечном слое | |
| 1 г DHA + 2 г EPA перорально | да | 148 | 7 дней до операции | нет | Противовоспалительное действие | Воспалительные маркеры | |
| 5-HEPE ↑ | |||||||
| LTB4 /% — HETE ↓ | |||||||
| 1 г DHA + 2 г EPA перорально | да | 148 | 7 дней до и через 7 дней после операции | нет | Нет существенной разницы между группой при инфекционных или неинфекционных послеоперационных осложнениях | Уровни ω3 ПНЖК в гранулоциты | |
| 0,6 г EPA / DHA (рыбий жир) перорально | нет | 23 | 63 дня | 5-FU + иринотекан + фолиновая кислота | Положительная модуляция состояния питания. CRP / альбумин ↓ | Оценка состояния питания и воспалительных маркеров | |
| 0,6 г EPA / DHA (рыбий жир) перорально | нет | 11 | 63 дня | CAPE + OXA + 5-FU + лейковорин | Улучшенные значения CRP, статус CRP / альбумина, профиль жирной кислоты плазмы и потенциально предотвращали потерю веса во время лечения | Оценка воспалительных маркеров и состояния питания | |
| 0,6 г EPA / DHA (рыбий жир) перорально | нет | 30 | 63 дня | Стандартная химиотерапия | Отсроченное время прогрессирования опухоли путем усиления противоопухолевого действия химиотерапии | Оценка времени прогрессирования опухоли и значений СЕА после химиотерапии | |
| 2 г ЭПК-СЖКперорально | да | 88 | Медиана 30 дней до операции | нет | Предоперационное лечение может иметь длительную пользу после послеоперационной общей и безрецидивной выживаемости | Ki67, CD31 и PGE2.Статистический анализ выживания (общая и безрецидивная выживаемость) |
ALFA (ОАС Pharma AG, Liestel, Швейцария) .
5-HEPE, 5-гидроксиэтоксисатетраеновой кислоты; LTB4, лейкотриен B4; 5-HETE, 5-гидроксиэтоксисатетраеновой кислоты; 5-FU, 5-фторурацил; CAPE, капецитабин (Xeloda); OXA, оксалоплатин; CRP, C реактивный белок; CEA, карциноэмбриональный антиген; PGE2, простагландин E.2 .
В последние годы многие исследования выявили наличие раковых стволовых клеток (CSC) в большинстве опухолей, включая рак кишечника или роака прямой кишки. Эти клетки считаются ответственными за рецидив опухолей и устойчивость к традиционным методам лечения.
Таким образом, новые противораковые стратегии были разработаны для избирательного нацеливания на CSC, и для этой цели естественные соединения, включая омега 3 ПНЖК, могли бы играть важную роль. В стволовых клетках рака толстой кишки (CSLC) De Carlo et al. показало, что EPA обладает преддифференцирующим эффектом, и этот вывод может, по крайней мере частично, объяснить повышенную клеточную чувствительность к 5-FU.
В соответствии с этими наблюдениями Ян и коллеги продемонстрировали, что EPA и DHA при однократном или комбинированном лечении усиливают химиотерапевтический эффект чувствительности 5-FU и митомицина C, индуцируя апоптозную гибель клеток CSLC.
Выводы
Хотя использование омега-3 в качестве потенциальных химиопревентивных и химиотерапевтических агентов часто предлагалось при лечении рака, полученные данные указывают на то, что эти соединения являются важными агентами для комбинированных стратегий против рака.
В частности, несмотря на некоторые противоречивые результаты, несколько экспериментальных и клинических данных сильно поддерживают роль омега 3 в качестве адъювантов, способных противодействовать возникновению воспалительных процессов во время лечения CRC, а также повышать эффективность химиотерапии или снижать ее токсичность.
Тем не менее, ни одно из исследований не учитывало первоначальный статус пациентов до приема ПНЖК или рекомендаций по питанию, что является важным вопросом для лучшего использования превентивного / терапевтического / адъювантного потенциала этих соединений.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5108786/
Copyright © 2016 Миккадей, Маселла, Милео и Гессани.
Это исследование было поддержано грантом проекта итальянской ассоциации исследований рака (AIRC) (IG 2013 № 14185) в SG
Другие статьи по теме кишечник: 1. Влияние омега-3 жирных кислот на кишечную микробиоту.
Другие статьи по теме рак: 1. Влияние добавок омега-3 на пациентов с раком желудка.
2. Потребление рыбы с омега-3 хороший способ профилактики рака молочной железы.
Добавить комментарий